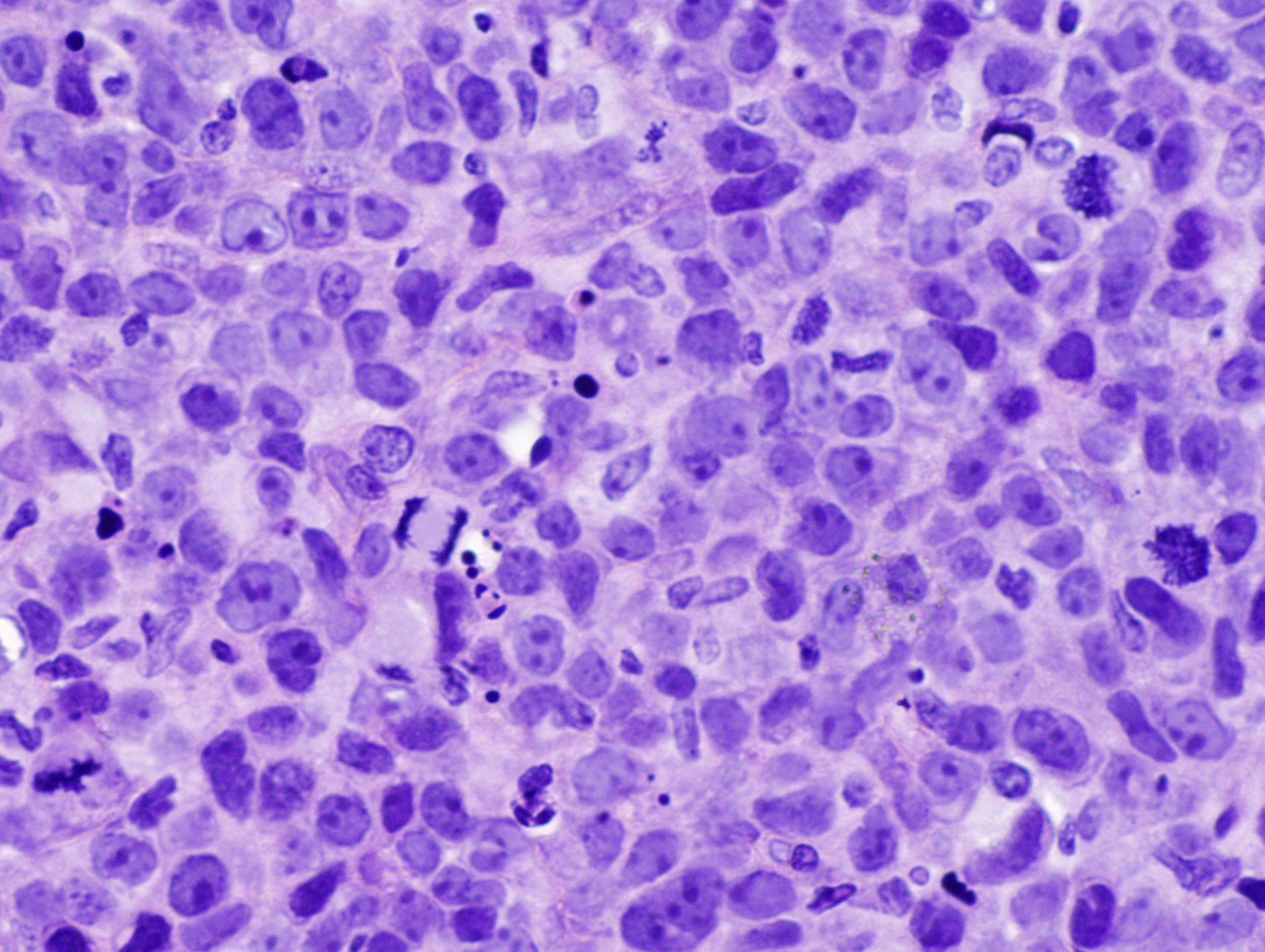
Pacientes com linfoma anaplásico sistêmico de grandes células (ALCL) começaram o ano de 2021 com uma boa notícia: em janeiro, a Food and Drug Administration (FDA), órgão estadunidense responsável pela análise e aprovação de medicamentos nos Estados Unidos, concedeu aprovação ao Xalkori para o tratamento da doença. Produzido sob a substância ativa crizotinibe, o medicamento, comercializado pela Pfizer obteve aprovação do órgão após um rigoroso ensaio com 26 portadores da doença.
O Xalkori se destina a pacientes pediátricos a partir de 1 ano de idade até jovens adultos jovens - até 21 anos - com linfoma anaplásico sistêmico de grandes células, seja recidivante ou refratário, com ALK-positivo. Sua eficácia foi comprovada durante o Estudo ADVL0912 (NCT00939770), produzido sob um ensaio multicêntrico, de braço único e aberto em pacientes com ALCL recidiva ou refratária, bem como ALCL ALK-positivo sistêmico - após, pelo menos, um tratamento sistêmico .
Durante os testes, os pacientes receberam Xalkori de 280 mg / m 2 (20 pacientes) ou 165 mg / m2 (6 pacientes), por via oral duas vezes ao dia, até a progressão da doença ou toxicidade inaceitável. A eficácia do Xalkori foi baseada na taxa de resposta objetiva (ORR), de 88%, com uma taxa de remissão completa de 81%. Além disso, houve registro de duração da resposta: 39% mantiveram a resposta por pelo menos 6 meses e 22% mantiveram a resposta por pelo menos 12 meses.