A Food and Drug Administration (FDA), agência reguladora de medicamentos nos Estados Unidos, concedeu aprovação ao Zytiga para o tratamento de câncer de próstata metastático de alto risco sensível à castração (CSPC). Comercializado pela Janssen, o medicamento é produzido com a substância ativa acetato de abiraterona e deve ser tomado em combinação com prednisona para maior eficácia do tratamento. A FDA ampliou a indicação do Zytiga, já que, anteriormente, havia aprovado o medicamento para tratar pacientes que haviam recebido quimioterapia anterior.
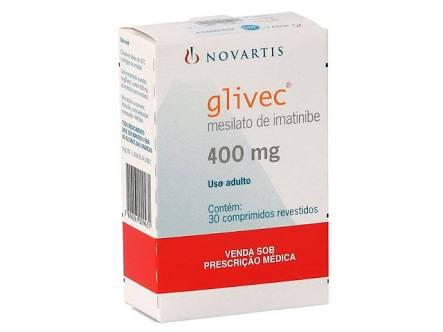
Produzido sob a substância ativa Imatinib, o Glivec recebeu a aprovação da European Medicines Agency (EMA), órgão regulador de medicamentos da União Europeia, após rigorosa análise do Relatório Público Europeu de Avaliação (EPAR). Disponível em cápsulas (50 e 100 mg) e comprimidos (100 e 400 mg), o Glivec é um medicamento anticancerígeno, que é destinado ao tratamento de pacientes com leucemia mielóide crônica (LMC), Leucemia linfoblástica aguda (LLA) Ph+, doenças mielodisplásicas ou mieloproliferativas (MD/MPD), síndrome hipereosinofílica avançada (HES), tumores estromais gastrointestinais (GIST) e dermatofibrossarcoma protuberans (DFSP).
Produzido sob a substância ativa ixazomib, o Ninlaro é um dos medicamentos a mais tempo aprovado pela European Medicines Agency (EMA), órgão regulador de medicamentos na Europa, para o tratamento de pacientes com mieloma múltiplo, um tipo de câncer na medula óssea.
De acordo com o Relatório Público Europeu de Avaliação (EPAR), o Zavesca recebeu aprovação do Comitê dos Medicamentos para Uso Humano (CHMP) para introdução ao mercado europeu. O comitê, que faz parte da European Medicines Agency (EMA), órgão regulador de medicamentos da União Europeia, atestou a eficácia do Zavesca para o tratamento de adultos com a doença de Gaucher tipo 1 e de adultos e crianças com a doença de Niemann-Pick tipo C, duas doenças hereditárias que afetam a forma com que o corpo lida com as gorduras.
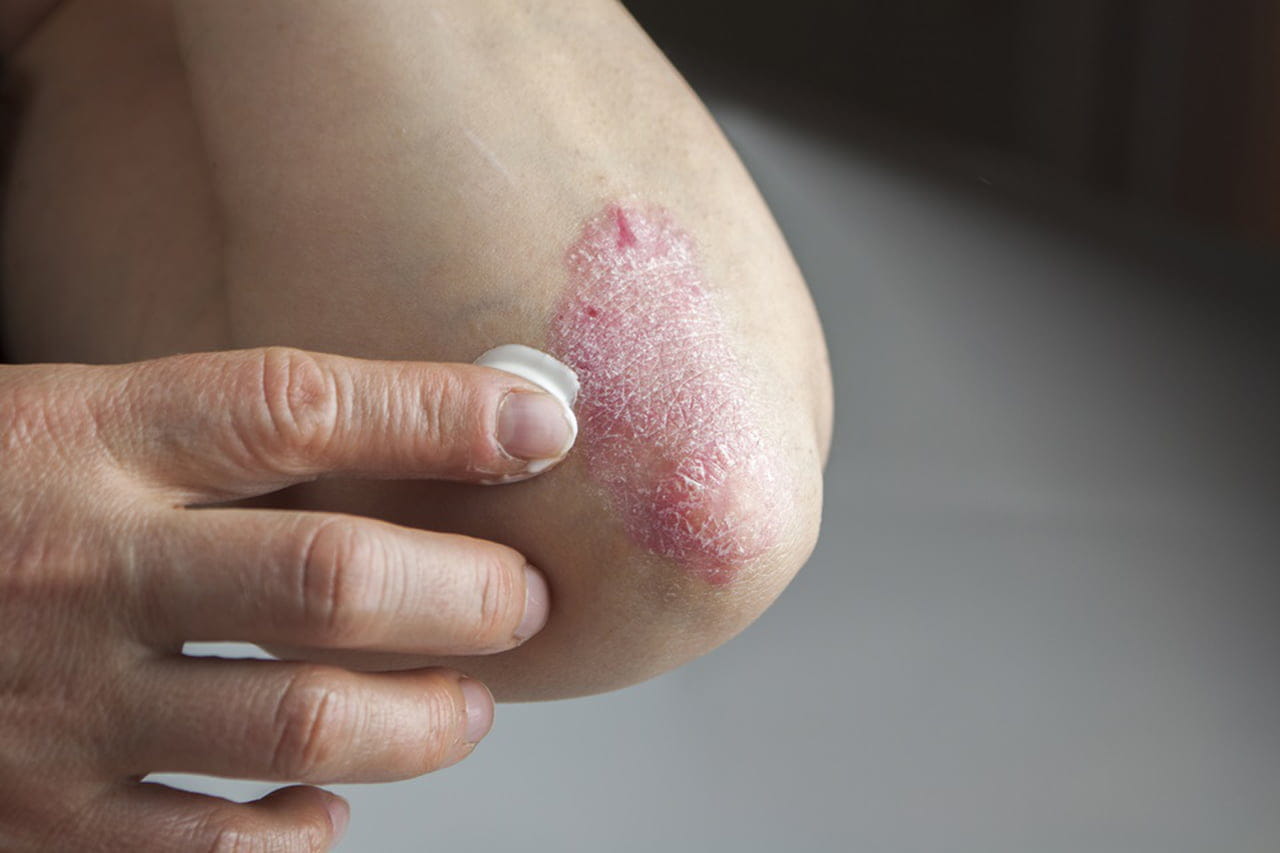
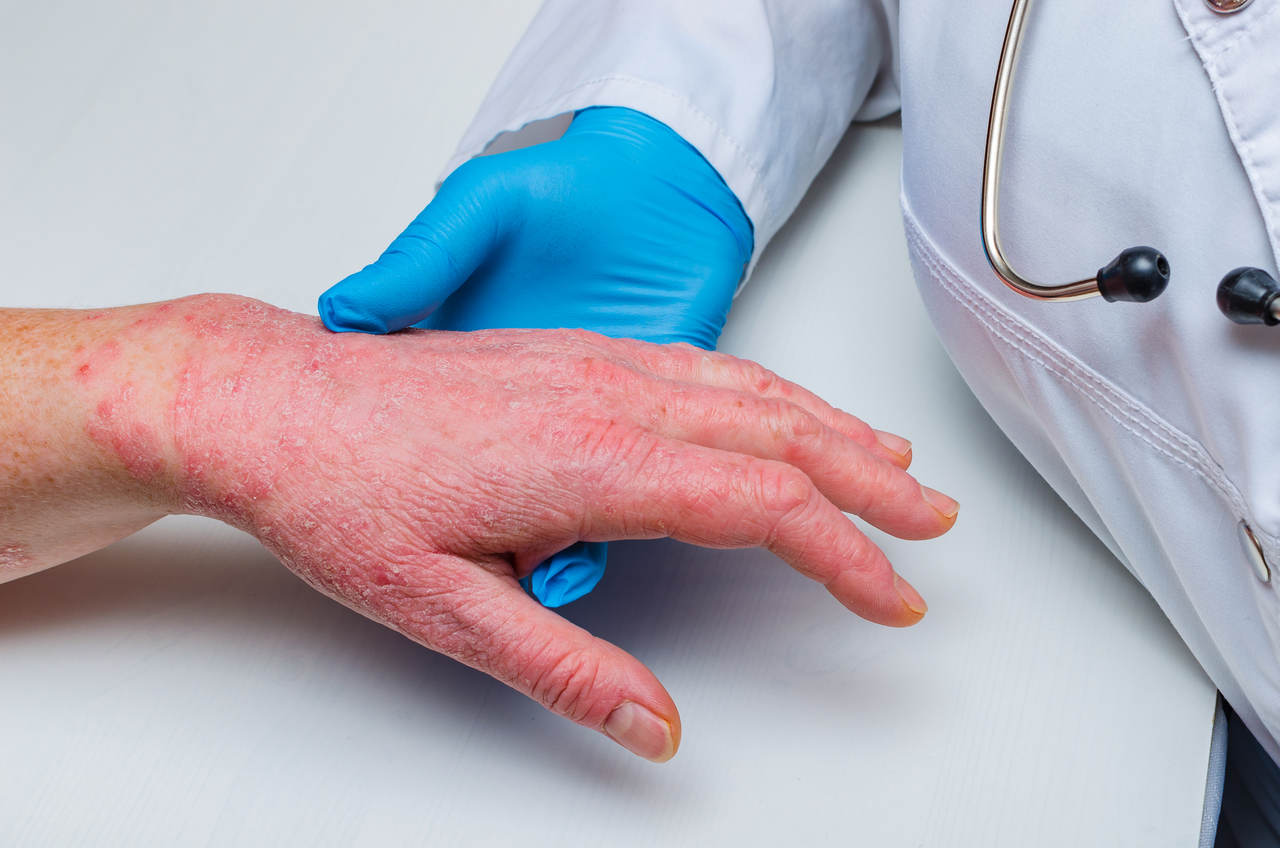
Os pacientes com psoríase receberam um alento no fim do ano passado. Isso porque, em dezembro, a Food And Drugs Administration - órgão regulador de medicamentos dos Estados Unidos - aprovou mais um medicamento para o combate à doença. Trata-se do Otezla, a primeira e única, até o momento, terapia oral aprovada para o tratamento de psoríase em placas, englobando todos os níveis da doença, desde casos leves até os mais graves. De acordo com a FDA, a aprovação é destinada a pacientes adultos com psoríase em placas candidatos a fototerapia ou terapia sistêmica, bem como pacientes adultos com artrite psoriática ativa e pacientes adultos com úlceras orais associadas à doença de Behçet.
Destinado ao tratamento de mieloma múltiplo - em combinação com os medicamentos REVLIMID (lenalidomida) e dexametasona em pessoas que receberam pelo menos 1 tratamento anterior - o Ninlaro recebeu a aprovação da Food And Drugs Administration, agência reguladora de medicamentos dos Estados Unidos, após estudos que comprovaram que a combinação com as substâncias lenalidomida + dexametasona registrou eficácia em pacientes cujo o mieloma múltiplo voltou ou parou de responder à terapia anterior.
Destinado a pacientes com Hipertensão Arterial Pulmonar (HAP), o Uptravi é um tratamento a longo prazo para adultos com Classe Funcional (CF) II–III da OMS. Comercializado pela Actelion, o medicamento recebeu a autorização da European Medicines Agency, em abril de 2017, com eficácia demonstrada em doentes com HAP - incluindo HAP idiopática e hereditária, HAP associada a doenças do tecido conjuntivo e HAP associada a cardiopatia congénita simples corrigida - por ajudar a retardar/desacelerar a progressão da sua doença e diminuir o risco de ser hospitalizado por HAP.
Produzido pela Wyeth, uma empresa do grupo Pfizer, o Somavert é comercializado em duas versões: 10 mg ou 15 mg de pó liofilizado injetável. Suas embalagens contêm 30 frascos-ampola da substância ativa pegvisomanto, somados a 30 frascos-ampola de diluente (com 8 mL de água para injetáveis). Com indicação para uso adulto, sua administração é via subcutânea, o Somavert tem como excipientes a glicina, manitol, fosfato de sódio dibásico e fosfato de sódio monobásico monoidratado. O objetivo do tratamento com o medicamento é normalizar os níveis séricos de IGF-I.
Aprovado pelo Food and Drugs Administration pela primeira vez em 22 de março de 2016, o Taltz é um medicamento dedicado ao tratamento de Psoríase em placas e Psoriática Artrite (doenças caracterizadas por lesões avermelhadas, inflamadas e elevadas, cobertas por escamas brancas prateadas) e Anquilosante Espondilite (inflamação de uma ou mais vértebras). Nome genérico para a substância ativa ixekizumab, o Taltz é produzido pela Eli Lilly and Company.
Medicamentos em Destaque
- All
- Acetato De Abiraterona
- Alergista
- Cardiologista
- Crizotinib
- Câncer
- Câncer De Mama
- Câncer De Pele
- Câncer De Próstata
- Câncer De Pulmão
- Daratumumab
- Dermatologia
- Esilato De Nintedanibe
- Fibrose Pulmonar
- Gastroenterologia
- Hematologia
- Hepatite C
- Hepatologia
- Hipertensão Pulmonar
- Ibrutinib
- Ledipasvir
- Leucemia
- Mastologia
- Melanoma
- Melanoma Avançado
- Mieloma Múltiplo
- Nilotinibe
- Oncologia
- Palbociclib
- Pembrolizumab
- Pneumologia
- Psoríase Em Placa
- Riociguat
- Sofosbuvir
- Urologia
- Ustequinumabe
- Vemurafenibe
- Default
- Title
- Date
- Random