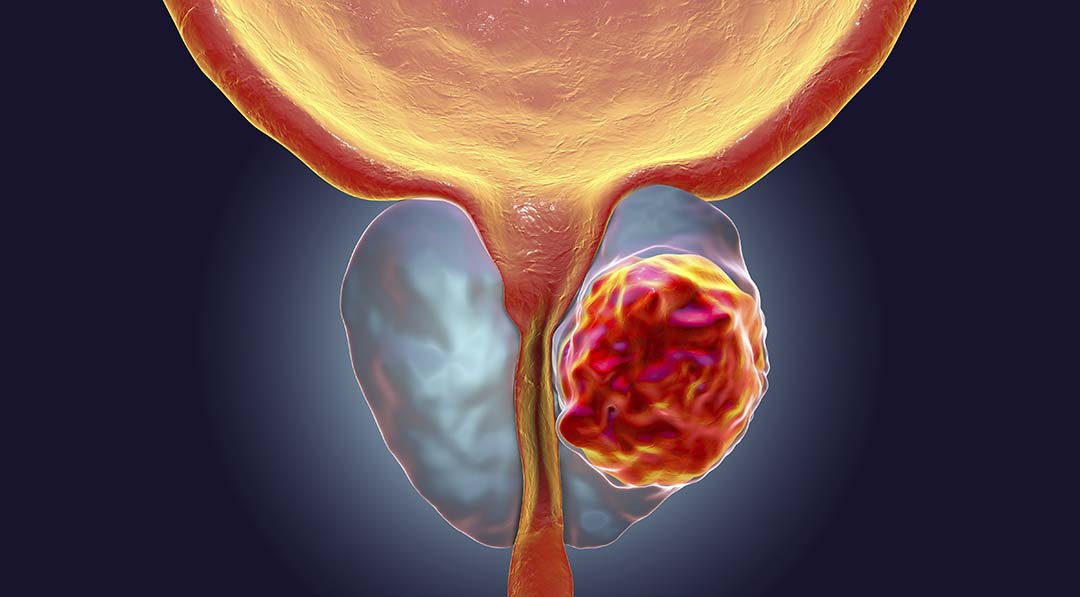
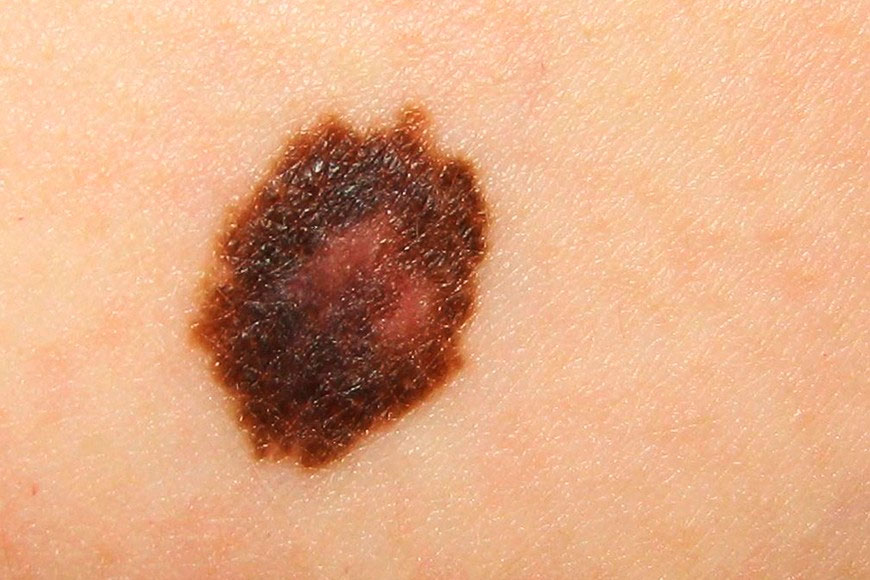
A Agência Europeia de Medicamentos (EMA) recomendou a aprovação do Zytiga para utilização na União Europeia. De acordo com o órgão regulador, o medicamento, quando utilizado em combinação com prednisona ou prednisolona demonstrou eficácia e retardou a progressão do câncer de próstata, bem como proporcionou aumento na sobrevida dos pacientes, como mostra o resumo do Relatório Público Europeu de Avaliação (EPAR) relativo ao Zytiga.
Produzido sob a substância ativa riociguat, o Adempas recebeu a aprovação da European Medicines Agency (EMA) para o tratamento de formas de hipertensão pulmonar (tensão alta nos vasos sanguíneos dos pulmões). A aprovação concedida pelo Comitê dos Medicamentos para Uso Humano ( CHMP ) do órgão regulador de medicamentos comercializados na União Europeia se destina a pacientes que não podem ser operados ou em casos onde a doença permanece ou retorna após intervenção cirúrgica.
Pacientes com câncer de pulmão de células não pequenas metastáticas (NSCLC) positivo (ALK) receberam uma dose de alívio com a aprovação do Alecensa para o tratamento da doença. Concedida pela Food and Drug Administration, um dos principais institutos reguladores de medicamentos em todo o mundo, a aprovação para o medicamento, produzido sob a substância ativa Alectinibe, se direciona a uma dose recomendada de 600 mg por via oral, duas vezes ao dia, sempre acompanhada de alimentos.
Pacientes com doenças pulmonares intersticiais (DPI) - crônicas com fibrose (cicatriz) com um fenótipo progressivo (traço) - receberam uma dose de esperança. Isto porque a Food and Drug Administration, órgão regulador de medicamentos dos Estados Unidos e um dos mais importantes do mundo, concedeu aprovação ao Ofev, produzido pela Boehringer Ingelheim Pharmaceuticals, o primeiro tratamento aprovado pela instituição para este grupo de doenças pulmonares fibrosantes.
Produzido pela Roche, o Erivedge recebeu aprovação da Food and Drug Administration - instituição estadunidense e um dos principais órgãos reguladores de medicamentos no mundo - para o tratamento de portadores de Carcinoma Basocelular (CBC). A eficácia contra o avanço do tipo de câncer de pele fez com que o medicamento fosse o primeiro aprovado pela FDA para a atuação em pacientes adultos, após demonstrar grande potencial em reduzir lesões desfigurantes ou potencialmente fatais por conta da doença.
Produzida pela Novartis Pharmaceuticals Corporation, o Tasigna recebeu aprovação da Food and Drug Administration para o tratamento de pacientes pediátricos de 1 ano de idade ou mais com leucemia mielóide crônica positiva para o cromossomo Filadélfia. A aprovação de um dos principais órgãos reguladores de medicamentos no mundo se direciona a pacientes recém-diagnosticados, em fase crônica (Ph + CML-CP ou Ph + CML -CP) resistente ou intolerante à terapia anterior com um inibidor de tirosina quinase (TKI).
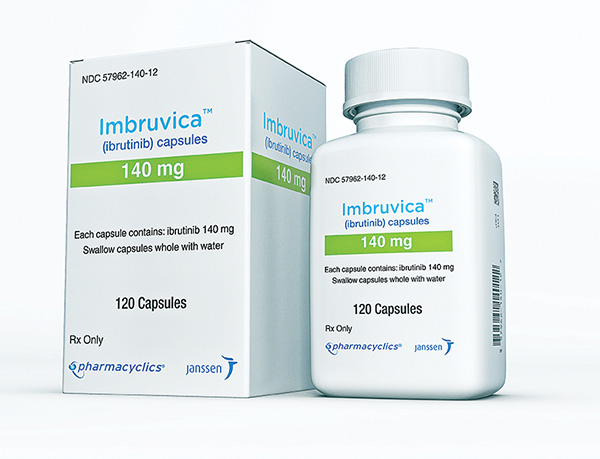
A Food and Drug Administration expandiu a indicação da substância ativa ibrutinibe (composição do Imbruvica para o tratamento inicial de pacientes adultos com leucemia linfocítica crônica (CLL), bem como linfoma linfocítico pequeno (SLL). A aprovação, feita em abril de 2020, é baseada na combinação do medicamento com outra substâcia ativa, a rituximabe e foi conduzida durante o Projeto Orbis, uma iniciativa do Centro de Excelência em Oncologia da FDA.
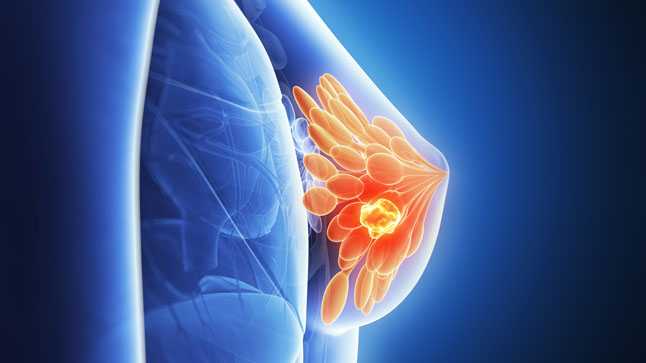
Órgão regulador de medicamentos nos Estados Unidos, a Food and Drug Administration concedeu aprovação ao Ibrance (palbociclib) para o tratamento de câncer de mama (HR+/HER2- , receptor hormonal positivo/receptor do fator de crescimento epidérmico humano 2 negativo), avançado ou metastático. Produzido pela Pfizer, o Ibrance deve ser combinado com um inibidor da aromatase como terapia endócrina inicial em mulheres pós-menopáusicas.
A European Medicines Agency recomenda o uso do medicamento Viekira para o tratamento de hepatite C crônica de longa duração em adultos. De acordo com o órgão regulador de medicamentos comercializados na União Europeia, o fármaco antiviral produzido pela AbbVie demonstrou grande eficácia no combate à doença infecciosa do fígado, agindo em combinação com outros medicamentos. Isso porque Viekira Pak atua, principalmente, na inibição da reprodução do vírus da Hepatite C em diferentes etapas da doença, graças aos inibidores de NS5A, de protease NS3/4A e de polimerase NS5B não-nucleotídeo.
Aprovado desde 2015 pela Food And Drug Administration, agência reguladora de medicamentos dos Estados Unidos, o Daklinza é um dos principais medicamentos direcionados ao tratamento da Hepatite C. Isto porque o fármaco atua contra a infecção crônica pelo genótipo 3 da hepatite C, um tipo específico da doença. Sob recomendação de utilização em combinação com a substância ativa sofosbuvir, o comprimido deve ser tomado uma vez ao dia, sob orientação médica.
Medicamentos em Destaque
- All
- Acetato De Abiraterona
- Alergista
- Cardiologista
- Crizotinib
- Câncer
- Câncer De Mama
- Câncer De Pele
- Câncer De Próstata
- Câncer De Pulmão
- Daratumumab
- Dermatologia
- Esilato De Nintedanibe
- Fibrose Pulmonar
- Gastroenterologia
- Hematologia
- Hepatite C
- Hepatologia
- Hipertensão Pulmonar
- Ibrutinib
- Ledipasvir
- Leucemia
- Mastologia
- Melanoma
- Melanoma Avançado
- Mieloma Múltiplo
- Nilotinibe
- Oncologia
- Palbociclib
- Pembrolizumab
- Pneumologia
- Psoríase Em Placa
- Riociguat
- Sofosbuvir
- Urologia
- Ustequinumabe
- Vemurafenibe
- Default
- Title
- Date
- Random