Em abril de 2021, A Food and Drug Administration - agência reguladora de medicamentos comercializados nos Estados Unidos - concedeu aprovação ao Opdivo (nivolumab) como primeira imunoterapia para o tratamento inicial de câncer gástrico, avançado ou metastático, bem como câncer de esôfago (adenocarcinoma na junção gastroesofágica). A aprovação acelerada, e inédita, do órgão para o tratamento da doença foi conduzida em combinação com certos tipos de quimioterapia.
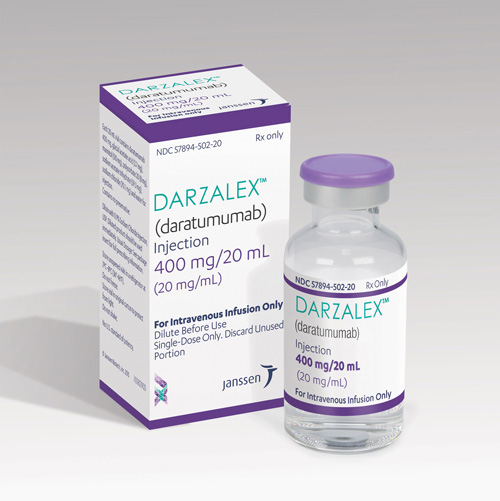
Pacientes com mieloma múltiplo receberam um importante aliado na luta contra a doença: a Food and Drug Administration (FDA) concedeu a autorização para a manipulação do Darzalex (daratumumab) para o tratamento do tipo de câncer de medula que afeta células plasmáticas. A aprovação da agência reguladora de medicamentos dos EUA foi considerada histórica, por se tratar do primeiro medicamento autorizado a utilizar anticorpos monoclonais (mAbs).
A European Medicines Agency (EMA), agência reguladora de medicamentos desenvolvidos por laboratórios farmacêuticos para uso em território Europeu, concedeu aprovação ao Keytruda para o tratamento de diferentes tipos de câncer, principalmente em fases avançadas. Durante uma bateria de testes, o medicamento demonstrou eficácia contra o câncer de pele melanoma, câncer de pulmão de células não pequenas (NSCLC), linfoma de Hodgkin clássico, câncer urotelial, carcinoma de células escamosas de cabeça e pescoço (HNSCC) e carcinoma de células renais.
A Food and Drug Administration (FDA), órgão regulador dos Estados Unidos para medicamentos em território nacional, concedeu aprovação ao Adcetris para o tratamento de Linfoma de Hodgkin e Leucemias. Três anos depois, a Agência Nacional de Vigilância Sanitária (ANVISA) também autorizou a utilização do medicamento em solo brasileiro, também seguindo a recórgão estadunidense, ou seja, para direcionamento a pacientes cuja doença progrediu após o transplante autólogo de células estaminais.
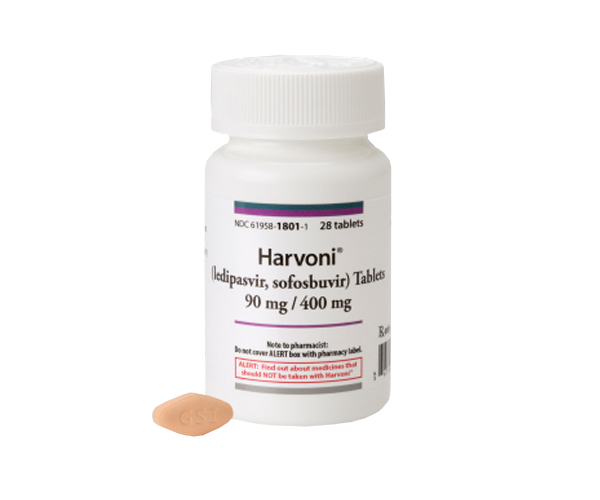
A Food and Drug Administration (FDA), agência federal do Departamento de Saúde e Serviços Humanos dos Estados Unidos, concedeu ao Harvoni (ledipasvir e sofosbuvir) a aprovação para o tratamento da hepatite C (VHC). A aprovação ao medicamento da Gilead Sciences foi concedida após rigorosos testes que comprovaram a eficácia do Harvoni como um potente antiviral na redução da quantidade do vírus da hepatite e, assim, impedindo a sua multiplicação.
Produzido pela Roche, o medicamento Perjeta é um dos medicamentos mais efetivos contra o câncer de mama. Prova disto é a tripla autorização recebida para o tratamento do tipo de câncer de mama HER2 positivo precoce e com alto risco de recorrência: da Food and Drug Administration (FDA), órgão regulador dos Estados Unidos; da European Medicines Agency (EMA), versão europeia do órgão regulamentador; e da Agência Nacional de Vigilância Sanitária (Anvisa), do Brasil.
A European Medicines Agency (EMA), principal órgão regulador de medicamentos em solo europeu, concedeu a aprovação ao medicamento Mepact para o tratamento de pacientes com osteossarcoma - câncer ósseo que surge nas células formadoras dos ossos- de alto grau. Produzido pela IDM Pharma, o Mepact é endereçado a pacientes entre 2 e 30 anos de idade (pediátricos, adolescentes e jovens adultos), que apresentem um grau operável e não metastático da doença, bem como apresentem ressecção cirúrgica macroscopicamente completa.
Produzido pela Pfizer, o Inlyta recebeu aprovação da European Medicine Agency (EMA), um dos principais órgãos reguladores de medicamentos do mundo, para o tratamento de câncer renal. Destinado a adultos, o medicamento ataca o câncer de células renais avançado e é indicado para casos onde a doença começou a se espalhar para outros órgãos, além de ser indicado para casos quando o tratamento com Sutent (sunitinib) ou “citocinas” (outros medicamentos contra o câncer) não se mostraram eficazes.
A Food and Drug Administration, agência reguladora de medicamentos dos Estados Unidos e um dos órgãos mais importantes do mundo para a medicina, concedeu a aprovação ao medicamento Ilaris para o tratamento de três doenças inflamatórias raras e graves. Produzido sob o princípio ativo canaquinumab, o Ilaris foi indicado ao tratamento da Síndrome Periódica Associada ao Receptor do Fator de Necrose Tumoral (TRAPS), Síndrome de Hiperimunoglobulina D (HIDS) / Deficiência de Mevalonato Quinase (MKD), bem como Febre Familiar do Mediterrâneo (FMF).
Responsável por uma inflamação no fígado com progressão silenciosa, a Hepatite C pode se tornar uma doença crônica e levar à cirrose e ao câncer, se não tratada devidamente. Considerada como um grande problema de saúde global, de acordo com a Organização Mundial da Saúde (OMS), a Hepatite C tem tratamento e deve ser devidamente tratada. Uma das prescrições médicas para a doença é a utilização do Sovaldi (produzido sob a substância ativa sofosbuvir), da Gilead.
Medicamentos em Destaque
- All
- Acetato De Abiraterona
- Alergista
- Cardiologista
- Crizotinib
- Câncer
- Câncer De Mama
- Câncer De Pele
- Câncer De Próstata
- Câncer De Pulmão
- Daratumumab
- Dermatologia
- Esilato De Nintedanibe
- Fibrose Pulmonar
- Gastroenterologia
- Hematologia
- Hepatite C
- Hepatologia
- Hipertensão Pulmonar
- Ibrutinib
- Ledipasvir
- Leucemia
- Mastologia
- Melanoma
- Melanoma Avançado
- Mieloma Múltiplo
- Nilotinibe
- Oncologia
- Palbociclib
- Pembrolizumab
- Pneumologia
- Psoríase Em Placa
- Riociguat
- Sofosbuvir
- Urologia
- Ustequinumabe
- Vemurafenibe
- Default
- Title
- Date
- Random