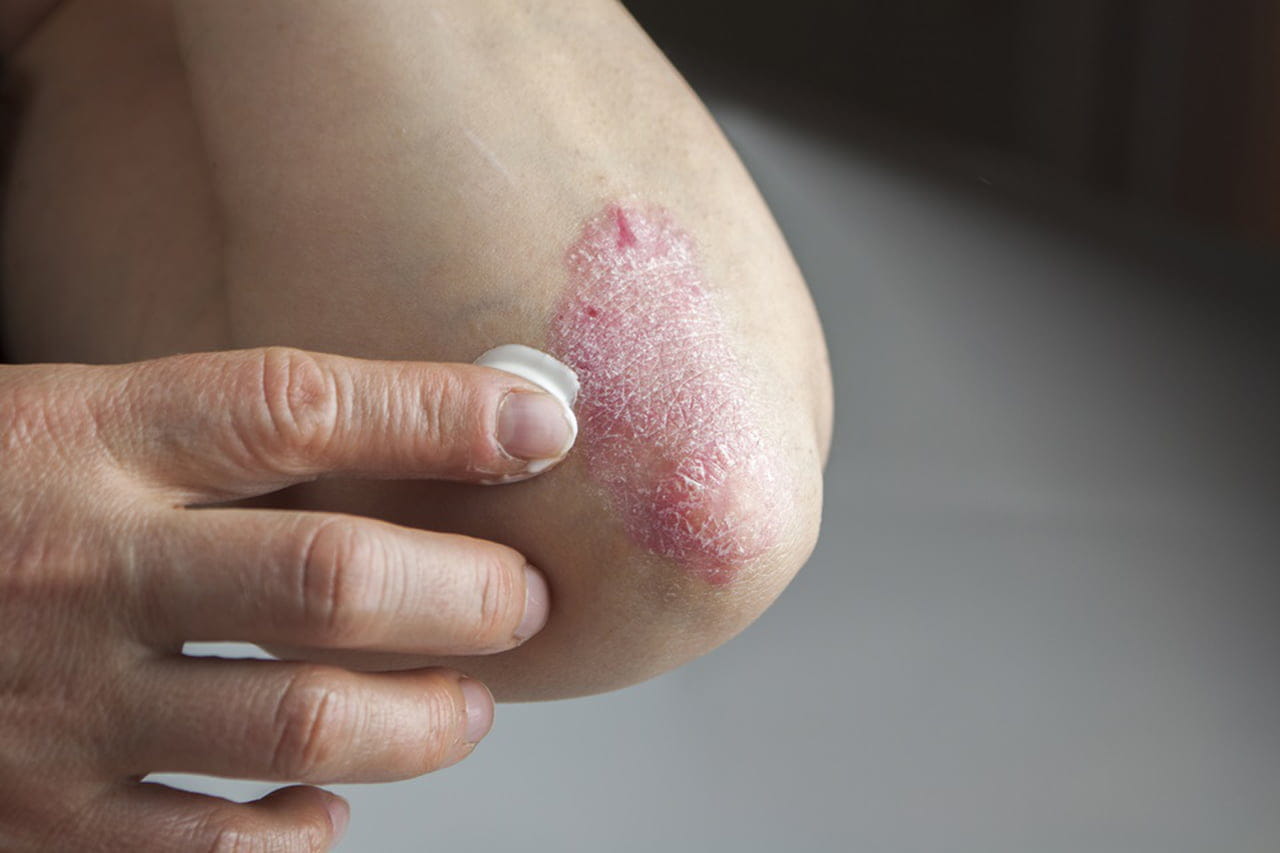
Os pacientes com psoríase receberam um alento no fim do ano passado. Isso porque, em dezembro, a Food And Drugs Administration - órgão regulador de medicamentos dos Estados Unidos - aprovou mais um medicamento para o combate à doença. Trata-se do Otezla, a primeira e única, até o momento, terapia oral aprovada para o tratamento de psoríase em placas, englobando todos os níveis da doença, desde casos leves até os mais graves. De acordo com a FDA, a aprovação é destinada a pacientes adultos com psoríase em placas candidatos a fototerapia ou terapia sistêmica, bem como pacientes adultos com artrite psoriática ativa e pacientes adultos com úlceras orais associadas à doença de Behçet.
A aprovação da FDA foi baseada nas descobertas do estudo Fase 3 ADVANCE que manipulou pacientes com Otezla oral 30 mg duas vezes ao dia. Os pacientes que receberam o medicamento atingiram o desfecho primário da resposta Static Physician's Global Assessment (sPGA) na semana 16, com diferença estatisticamente significativa se comparado ao placebo (21,6% versus 4,1%, p<0,0001). Considerando a Avaliação Global do Médico do Couro cabeludo (ScPGA), o Otezla também demonstrou melhorias expressivas nos principais sintomas (44% versus 16,6%) , bem como a resposta NRS Whole Body Itch (43,2% versus 18,6%), além de melhorias em Whole Body Itch NRS e resposta ScPGA, apresentadas já na semana 2 e mantidas até a semana 32.
Comercializado em forma de comprimidos revestidos, cada embalagem do Otezla contém 27 unidades (4 comprimidos de 10 mg, 4 comprimidos de 20 mg e 19 comprimidos de 30 mg) ou 56 unidades (todas elas de comprimidos 30 mg). Produzido sob o princípio ativo apremilast, a versão com 10 mg conta com os excipientes celulose microcristalina, lactose monoidratada, croscarmelose sódica, estearato de magnésio, álcool polivinílico, dióxido de titânio, macrogol, talco e óxido de ferro vermelho. Já a versão de 20 mg é acrescida de óxido de ferro amarelo e a de 30 mg de óxido de ferro amarelo e óxido de ferro preto.