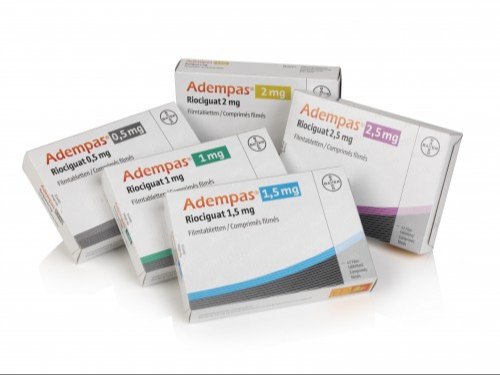
O Comitê Consultivo de Drogas Cardiovasculares e Renais da FDA (Food and Drug Administration) dos EUA recomendou, de forma unânime, o Adempas para o tratamento de pacientes com hipertensão pulmonar, doença crônica, progressiva e debilitante, que pode resultar transplante de pulmão ou até em óbito. Isto porque é caracterizada por uma pressão sanguínea anormal nas artérias dos pulmões, fazendo com que o lado direito do coração trabalhe mais do que o normal. Produzido com a substância ativa riociguat, o medicamento é destinado ao tratamento de pacientes adultos com hipertensão pulmonar tromboembólica crônica (HPTEC).
“O Adempas é o primeiro em sua classe de medicamentos aprovado para tratar hipertensão pulmonar e o primeiro medicamento de qualquer classe a se mostrar eficaz para pacientes com CTEPH”, afirmou Norman Stockbridge, Diretor da Divisão de Cardiovascular e Renal Drug Products no Centro de Avaliação e Pesquisa de Medicamentos da FDA. De acordo com a nota oficial da FDA, o Comitê avaliador da FDA afirmou que o "Riociguat também foi associado a melhorias em vários parâmetros de avaliação secundários relevantes nos estudos".
"Agradecemos a discussão do Comitê hoje em torno do uso seguro e apropriado do riociguat e estamos satisfeitos com o resultado das votações", comemorou Pamela A. Cyrus, médica, vice-presidente e chefe de assuntos médicos da Bayer HealthCare Pharmaceuticals nos Estados Unidos sobre o Adempas.
Vale ressaltar que os dados da pesquisa realizada pela FDA concluíram que a eficácia do Adempas foi observado nos resultados do programa clínico global de Fase 3, pesquisa com 704 pacientes divididos em dois estudos. Ambos os estudos alcançaram o objetivo primário, que era demonstrar melhora significativa aos pacientes durante o teste de caminhada de seis minutos (TC6). O resultado foi obtido após 16 e 12 semanas, respectivamente.